I sali in soluzione sono un argomento propedeutico
agli equilibri simultanei, alle titolazioni acido-base
(già viste quelle ossido-riduttive) e ai tamponi.
SALI IN SOLUZIONE – INDIVIDUAZIONE Ka E Kb
1) Si immette in acqua il cianuro di sodio. Dopo la
dissociazione il cianuro dà una reazione di idrolisi
basica formando acido cianidrico la cui Kb è 2,5 •
10-5.L’acido cianidrico formato, a sua volta, reagisce
con l’acqua facendo l’idrolisi inversa a dare cianuro.
Si calcoli la Ka. Dissociazione ionica in acqua:
\!\!\!\!\!\!\!\!\! \begin{matrix} Na^{+}CN^{-}\to Na^{+}+CN^{-}\\ \end{matrix}
Le idrolisi sono:

2) Dopo la dissociazione del bromuro d’ammonio,
lo ione ammonio dà idrolisi acida. L’ammoniaca
formata
subisce l’idrolisi inversa riformando parzialmente
lo ione ammonio con costante 1,85×10-5. Si calcoli
la Ka.
Dissociazione ionica in acqua:
\!\!\!\!\!\!\!\!\! \begin{matrix} NH_{4}^{+}Br^{-}\to NH_{4}^{+}+Br^{-}\\ \end{matrix}
Le idrolisi sono:
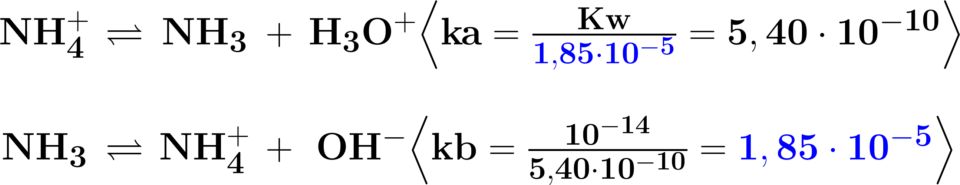
3) Data la reazione dell’acetato di sodio in acqua,
l’acetato formato idrolizza formando acido acetico
il quale, a sua volta, riforma l’acetato. Si calcoli la
Ka sapendo che la Kb precedente è 5,56×10-10.
Dissociazione ionica in acqua:
\!\!\!\!\!\!\begin{matrix} Na^{+}Ac^{-}\to Na^{+}+Ac^{-}\\ \end{matrix}
Le idrolisi sono:
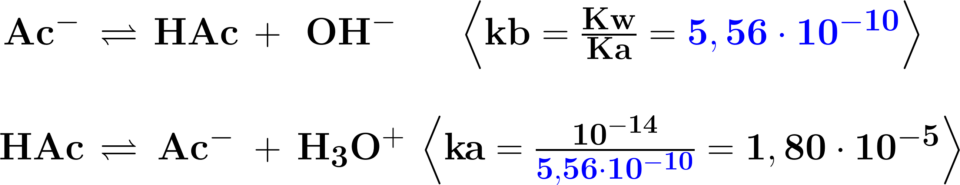
IL pH DEI SALI
1) L’acetato di calcio viene messo in acqua.
Conoscendo il suo titolo pari a 5,5 x 10-2M,
e la costante acido dell’acido acetico, si
calcoli il pH. La traccia la si può riassumere
così, dissociazione in acqua:
\!\!\!\!\!\!\!\!\!\!\!\! \begin{matrix} Ac_{2}Ca\; \to\; 2Ac^{-}\; +\;\;Ca^{2+}\\ \!5,5\!\cdot \!10^{-2}\; 2(5,5\cdot 10^{-2})\;\;\;\;\;\; \end{matrix}
Equilibrio incognito e quello dato dalla
traccia sono:
\!\!\!\!\!\!\!\!\!\!\!\!\footnotesize \begin{matrix} \textit{L'idrolisi basica incognita Kb=X è:}\\ Ac^{-}+H_{2}O \to HAc+H_{3}O^{+}\\ \\ \textit{L'idrolisi acida Ka=1,80}\cdot 10^{-5} è:\\ HAc+H_{2}O \to Ac^{-}+OH^{-} \end{matrix}
Poniamo 2•(5,5 • 10-2) come C e svolgiamo:
\!\!\!\!\!\!\!\!\!\footnotesize\begin{matrix} \textit{L'idrolisi basica Kb è:}\\ H_{2}O+Ac^{-}\to H_{3}O^{+}+HAc\\ (C-x)\; +X\;\;\;\;\\ \\ Kb=\frac{X^{2}}{C-X}\\ \\ Kb=\frac{Kw}{Ka}\\ \\ \frac{Kw}{Ka}=\frac{X^{2}}{C-X} \end{matrix}
Valutiamo se è possibile trascurare la x al
denominatore:
\large \!\!\!\!\!\!\!\!\!\begin{matrix} \frac{1,0\cdot 10^{-14}}{1,80\cdot 10^{-5}}=5,55\cdot 10^{-10}\\ \\ {\color{Green} 5,55\cdot 10^{-10}<10^{-4}}\\ \\ 2\cdot(5,5\cdot 10^{-2})=0,11\\ \\ {\color{Green} 0,11>10^{-2}}\\ \\ C-X \approx C\\ \end{matrix}
L’approssimazione è lecita, quindi:
\!\!\!\!\!\!\!\!\! \begin{matrix} \!\!\!\!\!\!\!\!\!\!\!\!\!\!\!\!\!\!X=\sqrt{Kb\cdot C}\\ \\ \!\!\!\!\!\!\!X\!=\!\sqrt{(5,55\!\cdot \!10^{-10})\!\cdot \!0,11}\\ \\ [OH^{-}]=7,81\!\cdot \!10^{-6}\\ \\ \!\!pH\!=\!14\!+\!log[OH^{-}]\!=\!8,89 \end{matrix}
2) Dato il secondo esercizio della pagina che
cito qui sotto:
\!\!\!\!\!\!\!\!\! \begin{matrix} \textit{diss. ionica in acqua}\\ NH_{4}^{+}Br^{-}\to NH_{4}^{+}+Br^{-} \end{matrix}
\!\!\!\!\!\!\!\!\!\!\!\! \begin{matrix} NH_{4}^{+}\rightleftharpoons NH_{3}+H_{3}O^{+}\\ \\ NH_{3} \rightleftharpoons NH_{4}^{+}+OH^{-}\\ \\ ka=\frac{Kw}{{\color{Blue} 1,85\cdot 10^{-5}}}=5,40\cdot 10^{-10}\\ \\ kb=\frac{10^{-14}}{5,40\cdot 10^{-10}}={\color{Blue} 1,85\cdot 10^{-5}} \end{matrix}
Si calcoli il pH avendo 0,210 M di bromuro
d’ammonio.
Valutiamo se è possibile trascurare la x al
denominatore:
\large \!\!\!\!\!\!\!\!\! \begin{matrix} {\color{Green} 5,40\cdot 10^{-10}< 10^{-4}}\\ \\ {\color{Green} 0,210> 10^{-2}}\\ \\ C-X \approx C \end{matrix}
L’approssimazione è lecita, quindi:
\!\!\!\!\!\!\!\!\!\!\!\! \begin{matrix} X\!=\!\sqrt{Ka\!\cdot \!C}\\ \\ X\!=\!\sqrt{(5,40\!\cdot \!10^{-10})\!\cdot \!0,210}\\ \\ [H^{+}]\!=\!1,07\!\cdot \!10^{-5}\\ \\ pH\!=\!-log[H^{+}]\!=\!4,97 \end{matrix}
Questo è tutto sui sali in soluzione. Il prossimo
argomento sono le titolazioni acido-base.
